
|
Vermehrung, Herpesviren, Varicella-Zoster, Epstein-Barr
 Der Begriff VIRUS leitet sich von dem lateinischen Wort für GIFT
ab. Er wurde während des ganzen 19.Jh. und noch zu Beginn des 20.
Jh. für infektiöse Erreger aller Arten benutzt. In den dreißiger
Jahren verwendeten die Wissenschaftler allgemein den Begriff "filtrierbares
Virus"; er bezeichnet alle Erreger, die ein Filter passieren konnten,
welches so feinporig war, dass es Bakterien zurückhielt. Heute nennt
man nur solche submikroskopischen Erreger Viren, die kleiner als 0,3 Mikrometer
sind.
Der Begriff VIRUS leitet sich von dem lateinischen Wort für GIFT
ab. Er wurde während des ganzen 19.Jh. und noch zu Beginn des 20.
Jh. für infektiöse Erreger aller Arten benutzt. In den dreißiger
Jahren verwendeten die Wissenschaftler allgemein den Begriff "filtrierbares
Virus"; er bezeichnet alle Erreger, die ein Filter passieren konnten,
welches so feinporig war, dass es Bakterien zurückhielt. Heute nennt
man nur solche submikroskopischen Erreger Viren, die kleiner als 0,3 Mikrometer
sind.
Diese Erreger,
deren Wirte Pflanzen, Tiere oder Bakterien sein können, sind Zellparasiten,
d.h. sie können sich nur in Inneren einer Wirtszelle vermehren. Das
Parasitenverhältnis kann zu Veränderungen der Wirtszelle führen
und so verschiedene Krankheiten verursachen, im schlimmsten Fall führen
diese Veränderungen zum Tod des Wirtsorganismus.
In den dreißiger Jahren klassifizierte man die Viren nach den Wirtsorganismen,
die sie infizieren. Man unterschied 3 Gruppen: Pflanzenviren, tierische
Viren und Bakterienviren (Bakteriophagen). Während mit dem Lichtmikroskop
nur eine 1000 bis 2000fache Vergrößerung möglich war,
erhielt man mit dem Elektronenmikroskop eine 300 000fache Auflösung.
So sind heute chemische Zusammensetzung, Symmetrie und Struktur die Grundlagen
für die Einteilung der Viren.
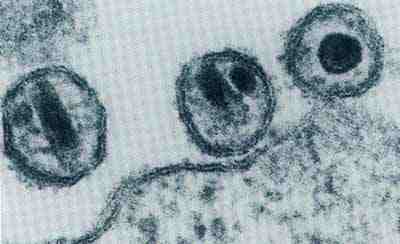 Fast alle Viren bestehen aus 2 Komponenten, einem Kern (Core)
mit der Nukleinsäure, die die genetische Information enthält,
und einer Hülle, die das Core umgibt und schützt.
Die Hülle besteht aus gleichartigen Proteinuntereinheiten und ist
in manchen Fällen noch von einer weiteren Hülle aus Lipiden
(Fettsubstanzen) umschlossen.
Fast alle Viren bestehen aus 2 Komponenten, einem Kern (Core)
mit der Nukleinsäure, die die genetische Information enthält,
und einer Hülle, die das Core umgibt und schützt.
Die Hülle besteht aus gleichartigen Proteinuntereinheiten und ist
in manchen Fällen noch von einer weiteren Hülle aus Lipiden
(Fettsubstanzen) umschlossen.
Die genetische Information eines Virus kann, wie bei allen lebenden Organismen,
in Desoxyribonucleinsäure (DNA) kodiert sein, bei manchen Viren erfüllt
jedoch Ribonucleinsäure (RNA) diese Aufgabe. Viren können doppelsträngige
DNA (Herpesviren), einzelsträngige DNA (Parvoviren), doppelsträngige
RNA (Reoviren) oder einzelsträngige RNA (Polioviren) enthalten.
Die RNA-Viren haben eine einzigartige Eigenschaft: Sie sind die einzigen
"Lebewesen", die sich zur Speicherung ihrer genetischen Information
der RNA bedienen. Bei allen anderen Lebensformen, die sich vermehren können,
erfüllt DNA diese Aufgabe.
|

|
Schritte der Virusvermehrung
Viren sind keine Zellen, aber sie brauchen Zellen. Sie müssen sich
an eine Wirtszelle anheften und in sie eindringen, um sich fortzupflanzen.
Die Viren der einzelnen Gruppen haben zwar verschiedene Wege zur Vermehrung
entwickelt, aber man kann dennoch die Vorgänge im Vermehrungszyklus
eines Virus allgemein zusammenfassen und so die Voraussetzung schaffen,
um einzelne Virusgruppen zu verstehen.
Praktisch alle Viren müssen in ihrem Vermehrungszyklus acht grundlegende
Schritte vollziehen:
Schritt 1: Das Virus heftet sich an die Wirtszelle.
Schritt 2: Das Virus oder seine genetische Information dringt
in die Zelle ein.
Schritt 3: Die Nucleinsäure wird von ihrer Hülle befreit,
sodass die Wirtszelle die genetischen Funktionen des Virus ausprägen
kann.
Schritt 4: Als Nächstes wird im Lebenszyklus vieler Viren
ein Teil der genetischen Information ausgeprägt, sodass nur eine
Untergruppe der viruscodierten Proteine gebildet wird; diese Proteine
bezeichnet man zusammenfassend als frühe Proteine des Virus. Sie
können auf mehreren Wegen wirksam werden: In manchen Fällen
tragen sie unmittelbar zur Vermehrung des Viruschromosoms bei. Bei anderen
Viren schalten sie viele Aktivitäten der Wirtszelle ab, sodass die
Stoffwechselwege der Zelle so weit wie möglich für die Virusproduktion
zur Verfügung stehen. Manche Viren können sich dagegen nur in
Wirtszellen vermehren, die sich selbst aktiv verdoppeln, und regen deshalb
die Wirtszelle zur Teilung an.
Schritt 5: Die Nucleinsäure des Virus vermehrt sich, sodass
das Viruschromosom schließlich in Hunderten oder sogar Tausenden
von Kopien vorliegt.
Schritt 6: Nun wird der zweite Teil der genetischen Information
des Virus ausgeprägt: die späten Gene. Sie kodieren Strukturproteine,
darunter auch die Hüllproteine.
Schritt 7: Die Hüllproteine finden sich zusammen und bilden
eine Kapsel um die Nucleinsäure des Virus.
Schritt 8: Wenn viele neue Kopien des Virus ausgereift sind, verlassen
sie die Zelle und greifen weitere Zellen an; dort beginnt der ganze Vorgang
von neuem.
|

|
Die menschlichen Herpesviren
Das Wort herpes kommt aus dem Griechischen und bedeutet "kriechen"
oder "schleichen", und das beschreibt sehr zutreffend die Ausbreitung
der Hautschäden um den Mund, die für diese Krankheit charakteristisch
sind; später nannte man sie Herpes fibrilis oder Herpes simplex.
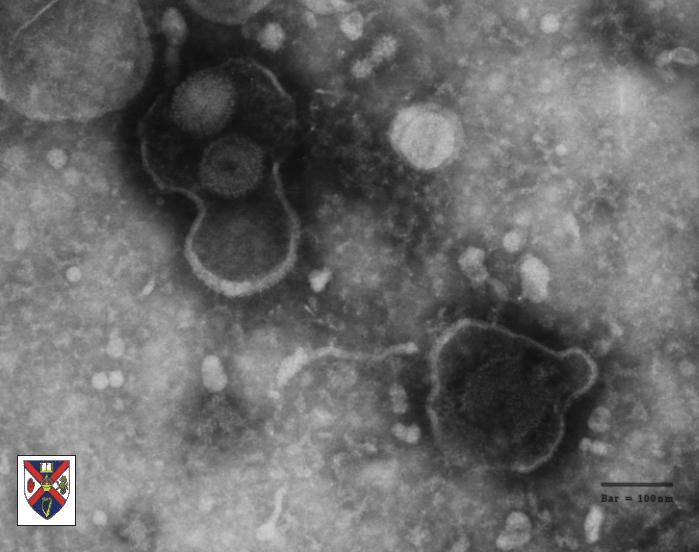 Die wichtigste Eigenschaft der Herpesviren ist ihre Fähigkeit,
sich im Körper zu verstecken - HSV-1 bedient sich dazu der Nervenzellen
- und in diesem Ruhezustand manchmal Jahre zu überdauern. Antikörper
können die Plasmamembran der Zellen nicht durchdringen, und deshalb
neutralisieren sie das latente HSV-1 in den Nervenzellen nicht.
Trotz unserer Immunabwehr leben so Herpesviren ständig mit uns zusammen. Die wichtigste Eigenschaft der Herpesviren ist ihre Fähigkeit,
sich im Körper zu verstecken - HSV-1 bedient sich dazu der Nervenzellen
- und in diesem Ruhezustand manchmal Jahre zu überdauern. Antikörper
können die Plasmamembran der Zellen nicht durchdringen, und deshalb
neutralisieren sie das latente HSV-1 in den Nervenzellen nicht.
Trotz unserer Immunabwehr leben so Herpesviren ständig mit uns zusammen.
Die Herpes-simplex-Viren des Typs 1 und 2:
Die beiden Viren sind eng verwandt und haben zu einem großen Teil
die gleichen Nukleotidsequenzen. Während jedoch HSV-1 bevorzugt den
Mundbereich und das Gesicht infiziert, findet man HSV-2 meistens im Genitalbereich.
HSV-1 wird über den Speichel oder bei inmittelbarem Körperkontakt
übertragen; die Ansteckung erfolgt gewöhnlich schon in den ersten
Lebensjahren. Die erste Infektion verläuft im Allgemeinen ohne Symptome.
Bei der Suche nach Antikörpern stellte sich heraus, dass ein Drittel
der Bevölkerung bereits in den ersten fünf Lebensjahren Kontakt
mit dem Virus hatte. Für die Gesamtbevölkerung aller Altersgruppen
liegt dieser Anteil bei 70 bis 80 Prozent.
Wenn HSV-1 in die Mundhöhle gelangt, heftet es sich an die Oberhautzellen
und vermehrt sich dort sowie in den Mund- und Lippenschleimhäuten.
Wenn es sich ausbreitet, kann es eine lokale Schädigung hervorrufen,
eine Blase. Antikörper neutralisieren die Viren in den Bläschen,
doch einige HSV-1 entkommen dem Immunsystem, indem sie sich im Mund an
Rezeptoren der Nervenenden anheften, die zu den Nervenknoten des Gesichtsnervs
(Trigeminus) führen. Das Virus dringt in ein Axon ein und wird dann
in den Nervenzellkörper und schließlich in deren Kern befördert.
Dort bleibt die Virus-DNA in einem Ruhezustand (Latenz), in dem
nur wenige ihrer Gene ausgeprägt werden. Verschiedene äußere
Reize können ein solches Wiederaufflammen der Infektion auslösen,
zum Beispiel körperliche oder seelische Belastungen, Fieber (deshalb
spricht man auch von Fieberbläschen), ultraviolette Strahlung aus
dem Sonnenlicht, Gewebeschäden und in manchen Fällen eine Immunschwäche.
Wie häufig die Herpesviren aktiviert werden, ist sowohl von genetischen
als auch von umweltbedingten Faktoren abhängig, und auch Alter und
Hormonveränderungen spielen dabei eine Rolle. Solche äußeren
Reize werden irgendwie zu den infizierten Nervenzellen der Gesichtsnervganglien
weitergeleitet und sorgen dort für eine Aktivierung der Virus-DNA,
d.h. sie setzen die Ausprägung der Virusgene und die Synthese der
Virusproteine in Gang. Die jetzt entstehenden Virusnachkommen werden durch
das Axon wieder an die Stelle der ursprünglichen Hautinfektion oder
in ihre Nähe transportiert und erzeugen dort ein Fieberbläschen.
Die wieder aktiven Viren kehren aber nicht mehr zur Nervenzelle zurück,
sondern werden von der Immunabwehr neutralisiert. In den Nervenknoten
liegen aber noch weitere Neuronen mit HSV-1-DNA, die bei der nächsten
Gelegenheit aktiviert werden kann.
Zur Infektion mit HSV-2 kommt es gewöhnlich durch sexuelle Kontakte.
Für die Latenz der Krankheit gelten die gleichen allgemeinen Gesetzmäßigkeiten
wie bei HSV-1, nur vermehrt sich HSV-2 nach der Erstinfektion nicht im
Mund, sondern in den Schleimhäuten und Oberhautzellen der Geschlechtsorgane.
Von dort wandert es durch Axone der sensorischen Nervenzellen des Genitalbereichs
in die Ganglien am unteren Ende des Rückenmarks. Bei einem Wiederaufflammen
der Infektion können zwar schmerzhafte Hautschäden entstehen,
häufig verläuft sie aber auch ohne Symptome. Mit der Zeit flammt
die Infektion gewöhnlich seltener auf, um schließlich ganz
zu verschwinden. Besorgniserregend ist nur die Tatsache, dass Frauen das
Virus an den Fetus oder während beziehungsweise nach der Geburt an
das Neugeborene weitergeben. Beim Neugeborenen sind die Auswirkungen einer
Infektion unterschiedlich schwer und ausgedehnt - möglich sind Enzephalitis,
Hautschäden, Keratokonjunktivitis (eine Augenerkrankung) oder Infektionen
mehrerer Körperbereiche. Da auch Patienten, die selbst keine Symptome
zeigen, das Virus ausscheiden können, werden Frauen, die früher
eine HSV-2-Infektion hatten, im allgemeinen durch Kaiserschnitt entbunden.
Bis vor etwa sieben Jahren gab es kaum Behandlungsmöglichkeiten
für HSV-Infektionen. Das änderte sich schlagartig, als man Aciclovir
entwickelte, ein Medikament, das drei Herpesviren sehr wirksam hemmt:
HSV-1, HSV-2 und das Varicella-Zoster-Virus, den Erreger der Windpocken.
Die entscheidende Eigenschaft des Wirkstoffes ist seine zielgenaue Giftwirkung:
Er tötet das Virus, aber nicht den Wirtsorganismus, weil er auf kleine
Unterschiede bei der zelleigenen und viruscodierten Form zweier wichtiger
Enzyme anspricht.
Das Aciclovirmolekül ähnelt des Desoxyguanosin, dem G-Baustein
der DNA. Die HSV-eigene Thymidinkinase verwechselt das Medikament mit
Guanosin und heftet an das Molekül eine Phosphatgruppe an. Das Virusenzym
phosphoryliert Acyclovir ungefähr 200 mal schneller als das zelleigene
Enzym, und deshalb enthält eine infizierte Zelle schon nach kurzer
Zeit einige hundertmal mehr phosphoryliertes Aciclovir als ihr nichtinfizierter
Nachbar. Die Verbindung, die dem normalen G-Nucleotid so stark ähnelt,
wird von zelleigenen Enzymen noch zwei weitere Male phosphoryliert, und
das so entstandene Aciclivirtriphosphat konkurriert nun mit dem Guanosintriphosphat
um den Einbau in die DNA. Auch hier bevorzugt ein Virusenzym, nämlich
die DNA-Polymerase, das Aciclovirtriphosphat gegenüber dem normalen
Monomer und fügt es in die entstehende Virus-DNA ein. Wenn Aciclovir
aber in die DNA-Kette eingebaut ist, verhindert es die weitere Kettenverlängerung:
Die HSV-codierte DNA-Polymerase heftet sich sehr fest an das Molekül
am Ende der DNA und wird unwiderruflich inaktiviert. Die Wirtszelle stirbt
zwar trotzdem, aber es entstehen weniger neue Viren, und das Immunsystem
kann ihre Ausbreitung wirksamer aufhalten, sodass sich der Gesamtorganismus
erholt.
|

|
Das Varicella-Zoster-Virus
Das dritte menschliche Herpesvirus ruft zwei verschiedene Krankheiten
hervor: Windpocken und Gürtelrose.
Mit Windpocken bezeichnet man normalerweise eine Kinderkrankheit, die
auf der ganzen Welt verbreitet ist. Das Virus gelangt über den Mund
in den Körper und vermehrt sich in den oberen Atemwegen. Nach einigen
Tagen geht der Erreger ins Blut über, und es kommt zur Virämie;
dann vermehrt er sich in allen Organen zu hohen Konzentrationen. Es folgt
eine zweite Virämie, durch die das Virus sich in der Haut ausbreitet
und dort den charakteristischen Ausschlag entstehen lässt. In diesem
Stadium finden sich die Viren in den Hautbläschen - jetzt ist der
Patient sehr ansteckend. Drei Tage nach dem Auftreten des Ausschlags beseitigt
das Immunsystem mit Killer-T-Zellen und Antikörpern die Viren, und
in den darauf folgenden Wochen heilen die Bläschen ab. Gewöhnlich
reicht eine einmalige Infektion aus, um uns für das ganze Leben vor
einer erneuten Windpockenerkrankung zu schützen.
Varicella-Zoster ist ein Herpesvirus und kann in einen latenten Zustand
übergehen. Während sich das Virus in den Hautzellen vermehrt,
dringt es auch in die sensorischen Neuronen ein, die zu den Rückenmarksganglien
führen und die Rumpfseiten sowie den Rücken versorgen. Bei den
meisten Menschen, die Windpocken hatten, bleibt das Virus in ruhendem
Zustand ein Leben lang im Körper.
Manchmal wird das Virus aber auch wieder aktiv. Dann wandert es durch
die Axone der sensorischen Neuronen in die Haut, wo es sich vermehrt und
den für Gürtelrose typischen, schmerzhaften Ausschlag entstehen
lässt. Die Gürtelform entsteht, weil die Viren den sensorischen
Nervenbahnen folgen. Anscheinend können mehrere Faktoren zur Reaktivierung
des Virus führen, z.B. die Hodgkin-Krankheit und andere Lymphome,
immunsuppressive Medikamente, Rückenmarksverletzungen, Belastungen
und Schwermetallvergiftungen. Außerdem tritt die Gürtelrose
häufiger bei älteren als bei jüngeren Menschen auf. Das
Virus kann im Laufe eines Lebens ein- oder mehrmals wieder aktiv werden.
Da auch das Varicella-Zoster-Virus seine eigene Thymidinkinase und DNA-Polymerase
kodiert, versucht man mit Aciclovir das Wiederaufflammen der Krankheit
zu verhindern und die Schmerzen zu lindern.
|

|
Das Epstein-Barr-Virus
Das Epstein-Barr-Virus (EBV) ist das vierte menschliche Herpesvirus.
Es wurde im Jahre 1964 durch M.A. EPSTEIN, B.G. ACHUNG und Y. M. BARR
entdeckt und erstmals beschrieben. Der Weg, der zur Entdeckung des Virus
führte, geht über den englischen Chirurgen Denis BURKITT, der
sich im Mulago Hospital in Kampala, der Hauptstadt Ugandas, mit der Verbreitung
bestimmter Krebserkrankungen in Afrika beschäftigte. Insbesondere
kam er zu dem Schluss, dass mehrere Tumorarten, die bei Kindern auftraten,
als einheitliches malignes Lymphom eingeordnet werden sollten,
also als Krebserkrankungen eines Typs der weißen Blutkörperchen,
nämlich der B-Zellen, die Antikörper produzieren. Burkitt erkannte,
dass mehrere Faktoren im Zusammenhang mit dem Auftreten der Krankheit
standen: Temperatur (geringe Höhe), häufige Regenfälle
und reichliche Wasservorkommen. Es zeigte sich eine Übereinstimmung
mit dem afrikanischen Malariagürtel. Burkitt behauptete: "Die
Tatsache, dass die Verteilung der Krebserkrankung von klimatischen Faktoren
abhängt, legt den starken Verdacht nahe, dass ein Überträger,
vielleicht eine Mücke, für ihre Verbreitung verantwortlich ist.
Das lässt vermuten, dass der Erreger ein Virus sein könnte."
Als Burkitt 1964 diese Vermutung äußerte, kannte man bereits
zahlreiche Viren, die bei Tieren Tumore hervorrufen, aber noch kein einziges
menschliches Tumorvirus. Im Jahr 1964 berichteten EPSTEIN und BARR sowie
unabhängig von ihnen auch R.J.B. PULVERTAFT, sie hätten die
krebsartig veränderten B-Zellen eines Patienten mit Burkitt-Lymphom
unbegrenzt lange in Zellkulturen weitergezüchtet. In jeder Kultur
konnte man recht regelmäßig mit dem Elektronenmikroskop Herpesviren
identifizieren.
Die Wissenschaftler Werner und Gertrude HENLE, die beide am Kinderkrankenhaus
von Philadelphia arbeiteten, entwickelten einen Test, mit dem sie Antikörper
bei Patienten mit Burkitt-Lymphom nachweisen ließen. Die Antikörper
reagierten nicht mit gesunden B-Zellen, sondern nur mit solchen, die aus
dem Burkitt-Lymphom stammten. Das war möglicherweise ein Nachweisverfahren
für den Erreger in den Zellen des Burkitt-Lymphoms, den man nun als
Epstein-Barr-Virus bezeichnete. Dann erlebten die HENLEs eine Überraschung.
Nachdem sie zuerst feststellten, dass die meisten Afrikaner Antikörper
hatten, die sie Burkitt-Lymphom-Zellen erkannten, fanden sie diese auch
bei ihren Labormitarbeitern und schließlich bei einem hohen Anteil
der Bevölkerung aus aller Welt, von denen man nach dem Zufallsprinzip
Proben entnommen hat. Die Untersuchungen ergaben, dass das Epstein-Barr-Virus
ein neues, vermutlich menschliches Herpesvirus sein musste, das offensichtlich
überall auf der Welt verbreitet war.
Wie so oft in der Geschichte kam auch den HENLEs der Zufall zu Hilfe:
Eine ihrer technischen Assistentinnen erkrankte am Pfeifferschen Drüsenfieber
(infektiöse Mononucleose). Als sie wieder zur Arbeit kam und
man ihr routinemäßig eine Blutprobe entnahm, um sie auf Viren
zu untersuchen, enthielt das Blut in hoher Konzentration Antikörper
gegen die B-Zellen des Burkitt-Lymphoms, obwohl der gleiche Test vor der
Erkrankung negativ war. Die B-Zellen der Assistentin wurden in Gewebekulturschalen
gezüchtet. Sie vermehrten sich unbegrenzt weiter (sie waren immortalisiert),
enthielten ein Antigen, das mit den Antikörpern aus Patienten mit
Burkitt-Lymphom reagierte und setzten schließlich Viruspartikel
frei, die von dem EBV aus dem Burkitt-Lymphom nicht zu unterscheiden waren.
Weitere Untersuchungen von Blutproben erhärteten den Verdacht des
HENLEs, dass EBV der Erreger des Pfeifferschen Drüsenfiebers ist.
Eine EBV-Infektion in jungen Jahren verläuft häufig ohne Symptome.
Da die infektiöse Mononuclease mit dem Speichel übertragen wird,
nennt man sie auch die "Kusskrankheit". EBV vermehrt sich in
den Epithelzellen von Mundhöhle, Zunge und Speicheldrüsen. Oft
zeigt der Betroffene in dieser Phase kaum Symptome, obwohl eine hohe Ansteckungsgefahr
besteht. Später breitet sich das Virus auf die Lymphknoten in der
Umgebung der Mundhöhle aus, wo sich die B- und T-Zellen des Immunsystems
befinden. Dort kann es die B-Zellen infizieren, nicht aber die T-Zellen.
Dort exprimiert es einen Teil seiner Proteine, die die B-Zellen dazu anregen,
sich zu Klonen identischer Tochterzellen zu vermehren. Diese Phase der
Krankheit beginnt oft erst lange nach dem ersten Viruskontakt, also nach
einer langen Latenzzeit. Ihre Symptome sind Rachenentzündung, Fieber
und Schmerzen, mitunter auch Krankheitssymptome der Milz und der Leber
und auch schwere Krankheitszustände, wenn die mononuklearen B-Zellen
ins Nervensystem eindringen.
Meistens jedoch behält das Immunsystem die Oberhand, weil die T-Zellen
die infizierten Epithelzellen und B-Zellen nach und nach dezimieren. Peronen
aber, deren Immunsystem aus genetischen Gründen, durch AIDS oder
eine Chemotherapie geschwächt ist, bekommen nach einer EBV-Infektion
häufig ein tödliches B-Zell-Lymphom. Dabei dringt das Virus
in die B-Zellen ein und regt das polyklonale B-Zell-Wachstum an, aber
die Killer-T-Zellen versagen, sodass die ungezügelte Vermehrung der
B-Zellen (das Lymphom) den Betroffenen tötet. Überraschenderweise
unterscheiden sich diese Tumore in Erscheinungsbild und Entstehungsort
stark vom Burkitt-Lymphom, obwohl in beiden Fällen das gleiche Virus
die Ursache ist.
Bei den meisten Patienten lassen die Symptome der infektiösen Mononuclease
im Laufe der Zeit nach, und der Normalzustand stellt sich wieder ein.
Aber die besondere Eigenschaft der Herpesviren ist die Latenz, ihre Fähigkeit,
in nichtinfektiöser Form zu überdauern. Alle Menschen, die jemals
mit EBV infiziert waren, tragen in einem kleinen Teil ihrer B-Zellen die
DNA des Virus, gleichgültig, ob sie irgendwann einmal an Krankheitssymptomen
gelitten haben oder nicht. Die EBV-DNA macht diese B-Zellen unter geeigneten
Bedingungen in einer Zellkultur unsterblich.
Wie ein Virus, das sonst überall in der Welt das Pfeiffersche Drüsenfieber
hervorruft, in begrenzten Gebieten Afrikas und Neuguineas aber das Burkitt-Lymphom
und in Südchina ein Nasen-Rachen-Karzinom hervorrufen kann, ist noch
nicht in allen Einzelheiten geklärt. Fest steht, dass einerseits
Umwelteinflüsse eine Rolle spielen und andererseits aber in einem
besonderen Maß auch genetische Faktoren. Neuere Untersuchungen am
Burkitt-Lymphom haben gezeigt, dass eine Chromosomenverschmelzung am 46
Chromosom bei nahezu allen Fällen zu finden ist. Beim Burkitt-Lymphom
findet man an der Bruchstelle der Chromosomentranslokation stets das gleiche
Gen, das infolge der Informationsverwirrung besonders stark exprimiert
wird, was auf eine noch nicht genau geklärte Weise zur Krebsentstehung
beiträgt.
Als weitere Beispiele für menschliche Herpesviren sollen hier nur
drei Viren erwähnt werden, die sehr verbreitet, aber dennoch nur
wenig untersucht sind: das Cytomegalievirus (CMV) und die
Herpesviren vom Typ 6 und Typ 7.
|

